Aminación
Las aminas son intermediarios increíblemente útiles y son una funcionalidad clave de la mayoría de las moléculas biológicamente activas.
En la práctica moderna de la síntesis orgánica, las reacciones más comunes para formar enlaces de C-N, además de las síntesis de amidas, son la sustitución nucleófila de haluros alquílicos y la aminación de Buchwald-Hartwig de haluros arílicos. Otra es la aminación reductora de carbonilos, la cual no se trata en este artículo.
Aminación de haluros alquílicos
A menudo denominada como alquilación de aminas, la sustitución nucleófila de haluros alquílicos con aminas alifáticas o heteroaromáticas es una reacción orgánica «histórica». Es una reacción relativamente simple, bien establecida y todavía un método principal para la alquilación de aminas con compuestos alifáticos.
Por el contrario, la sustitución nucleófila aromática se ha abandonado casi por completo en favor de métodos más suaves y, a la vez, más sólidos y eficaces, como el acoplamiento de enlaces de C-N de Hartwig-Buchwald.
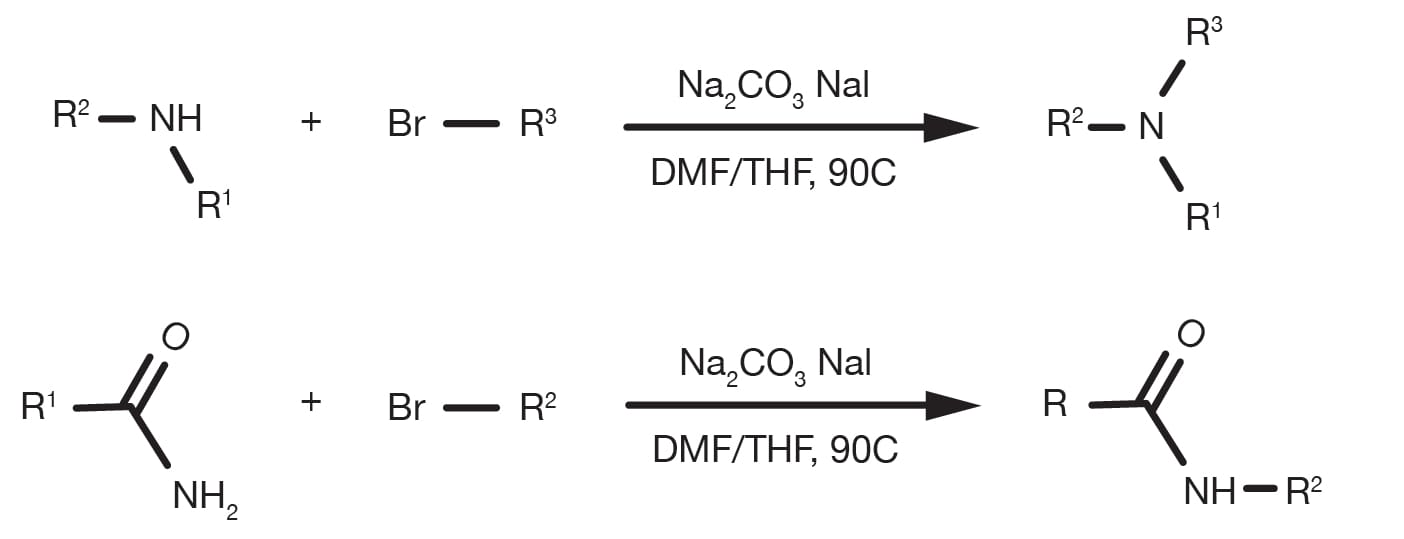
La aminación de haluros alquílicos puede realizarse en diferentes disolventes, de los cuales los más comunes son DMF y THF y se produce en presencia de una base, como carbonato sódico o aminas terciarias. La temperatura es un parámetro clave que influye en la cinética de la reacción y, aunque la sustitución se puede producir a temperatura ambiente, se han notificado en muchas ocasiones condiciones de reflujo para componentes básicos con menor reactividad. Para la alquilación de aminas heteroaromáticas suele ser necesario el uso de bases fuertes, como bis(trimetilsilil)amida de sodio y condiciones criógenas.
La tasa de alquilación sigue el orden amina primaria > amina secundaria > amina terciaria y la reactividad de los derivados de haluros sigue la electronegatividad del sustituyente del haluro. El bromuro y los yoduros son los componentes básicos más prácticos, mientras que los cloruros siguen siendo muy comunes dada su amplia disponibilidad comercial. El uso de yoduro sódico es una manera práctica de generar un yoduro alquílicoin situ más reactivo en caso de que el material de inicio sea un haluro diferente.
La sustitución nucleófila de haluros alquílicos no se considera una reacción muy ecológica, ya que produce un subproducto de ion haluro. Los métodos industriales a gran escala para la producción de aminas simples tienden a preferir la aminación de alcoholes, ya que el subproducto es agua. Dicho esto, sigue siendo una pieza indispensable en una caja de herramientas de un químico orgánico sintético.
Protocolos de reacción de referencia
Prepare una solución de la amina y el haluro alquílico en DMF. El uso de excedente de cualquier material inicial es beneficioso (1,5-2 equivalentes). Añada 1,5 equivalentes de la base y, en caso de que el haluro sea un bromuro o un cloruro, 1,5 equivalentes de yoduro sódico. Mezcle en RT durante 12-24 h. Para componentes básicos de menor reactividad, es necesario aumentar la temperatura hasta las condiciones de reflujo. Al final de la reacción, enfríe rápidamente con agua, extraiga con un disolvente orgánico adecuado (p. ej., acetato de etilo) y siga con la purificación del producto.
Ejemplos

Referencia de patente: WO2015088045

Referencia de patente: WO2014152144
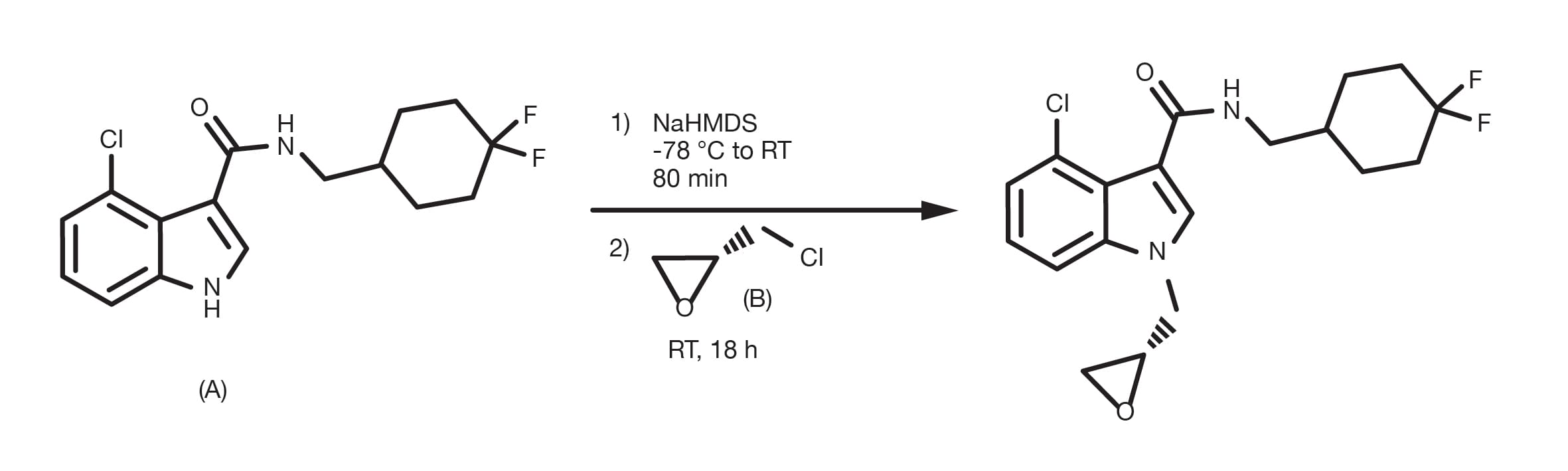
Referencia de patente: WO2016100281
Referencias bibliográficas clave
- Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry (2000). doi:10.1002/14356007.a02_001
Selección del producto
Ingredientes y aditivos básicos:
1,8-Diazabiciclo[5.4.0]undec-7-ene (DBU)
Solución de bis(trimetilsilil)amida de sodio
Bis(trimetilsilil)amida de sodio sólido
USE LA BARRA DE BÚSQUEDA SITUADA EN LA PARTE SUPERIOR DE LA PÁGINA PARA REALIZAR BÚSQUEDAS ESPECIFICAS POR NOMBRE DE PRODUCTO O NÚMERO CAS
Componentes básicos:
USE LA HERRAMIENTA DE BÚSQUEDA DE ESTRUCTURAS QUÍMICAS PARA BUSCAR EL COMPONENTE BÁSICO QUE NECESITA
Bromuros alquílicos sustituidos de diversas maneras:
Cloruros alquílicos sustituidos de diversas maneras:
Yoduros alquílicos sustituidos de diversas maneras:
Nucleófilos:
Acoplamiento de enlaces de C-N
Aunque los primeros acoplamientos de enlaces de C-N se notificaron en los años 80 del siglo XX, no fue hasta el trabajo de los profesores Buchwald y Hartwig desde 1994 hasta nuestros días que el acoplamiento catalizado por paladio se ha convertido en el método preferido para la síntesis de aminas aromáticas. El uso de condiciones de reacción suaves y una nueva generación de catalizadores muy activos y estables en el aire han desplazado a métodos más duros, como la sustitución aromática nucleófila, a la vez que han ampliado el alcance del sustrato de la transformación.
El trabajo del profesor Buchwald está sistemáticamente entre los más citados de la bibliografía química y el acoplamiento de enlaces de C-N de Buchwald-Hartwig es una de las reacciones más generalizadas de la práctica de la síntesis orgánica moderna, un paso fundamental en la producción de muchos compuestos biológicamente activos de interés comercial.
La reacción permite el acoplamiento catalizado por paladio de prácticamente cualquier amina con haluros aromáticos o heteroaromáticos sustituidos de diversas maneras o triflatos. La reacción se produce en presencia de una base y se puede realizar en muchos disolventes diferentes, los más habituales son el tolueno, THF dioxano y DME. Incluso alcoholes, como terc-butanol o terc-alcohol amílico (con preferencia a temperaturas elevadas) son buenas opciones.
Un acoplamiento de enlaces de C-N habitual se realiza a 50-100 °C durante hasta 24 h, aunque se notifican de forma habitual conversiones completas en tan solo unas pocas horas.
Posiblemente, la base más versátil para esta reacción es el butirato de sodio, aunque a menudo es necesario volver a las bases más débiles para evitar reacciones secundarias con grupos funcionales electrófilos o la epimerización de carbonos ácidos.

La combinación de la fuente de paladio(0) y el ligando es el parámetro práctico más importante para un acoplamiento correcto de enlaces de C-N. Existen muchas opciones para la transformación, desde precursores y ligandos metálicos de la antigua generación, como el acetato de paladio y BINAP, o bien 1,1'-bis (difenilfosfino) ferroceno [dppf], a catalizadores preformados de la generación moderna, como los ciclos de paladio de 4.ª generación o los complejos de paladio π-alílicos. Con el paso de los años, el uso de fosfinas quelantes más ricas en electrones, como ligandos de tipo «Josiphos» y trialquifosfinas, ha ampliado el alcance del sustrato y ha suavizado las condiciones de reacción. Sin embargo, entre las muchas opciones catalíticas disponibles, solo unas pocas han tenido amplias aplicaciones prácticas. Los parámetros clave para la selección del catalizador son una combinación de facilidad de uso (p. ej., estabilidad del aire), robustez, alcance del sustrato y disponibilidad comercial. Los catalizadores de la generación moderna, basados en los voluminosos ligandos de dialquilbiarilfosfina, investigados en primera instancia por Buchwald y Hartwig, ofrecen varias ventajas gracias a su estabilidad del aire y a su excepcional actividad y han ampliado enormemente el alcance de la reacción. Ahora mismo, son los ligandos que se usan con más frecuencia en las reacciones de los acoplamientos de enlaces de C-N.
Protocolos de reacción de referencia
Se puede encontrar una guía práctica increíblemente útil para identificar las mejores condiciones de reacción para un acoplamiento de enlaces de C-N de Buchwald en Chem. Sci., 2011, 2, 27 (DOI: 10.1039/c0sc00331j). Un protocolo de referencia es de la siguiente manera:
Preparar una solución de tolueno con el haluro de arilo y la amina en cantidades equimolares, el catalizador de paladio (o la mezcla de ligando y precursor de paladio) y 2 equivalentes de base (carbonato de cesio o terc-butirato de sodio). Un buen punto de partida para las condiciones de cribado es el uso de una carga de catalizador del 5-10 % que puede reducirse posteriormente con algún trabajo de optimización. La reacción se lleva a cabo agitando a temperaturas de entre 90 y 140 °C, preferiblemente bajo atmósfera de nitrógeno (obligatorio para los catalizadores no estables al aire). Los tiempos de conversión pueden ser muy cortos, incluso por debajo de una hora, aunque por lo general se documentan tiempos de reacción de entre 12 y 24 h.
El uso de un catalizador de última generación hace que la reacción sea especialmente sencilla, ya que los complejos de paladio estables en aire pueden utilizarse sin necesidad de una caja seca y la reacción se realiza en material de vidrio normal de laboratorio. Los catalizadores no tan recientes y, en particular, el uso de especies activas de paladio(0) requieren algunas precauciones que van más allá del alcance de este texto.
Ejemplos

Referencia de patente: WO2012112946

Referencia de patente: WO2016012477
Referencias bibliográficas clave
- J. Am. Chem. Soc., 1994, 116 (13), pp 5969–5970 DOI: 10.1021/ja00092a058
- J. Am. Chem. Soc., 1994, 116 (17), pp 7901–7902 DOI: 10.1021/ja00096a059
- Journal of Organometallic Chemistry 1999, 576, pp 125-146 https://doi.org/10.1016/S0022-328X(98)01054-7
- Chem. Sci., 2011, 2, 27 DOI: 10.1039/c0sc00331j
- Angewandte Chemie 2008, 47, pp 6338-6361 https://doi.org/10.1002/anie.200800497
Selección del producto
Disolventes:
CONSULTE TODOS NUESTROS DISOLVENTES: MÁS DE 1000 ALTERNATIVAS
Componentes básicos:
USE LA HERRAMIENTA DE BÚSQUEDA DE ESTRUCTURAS QUÍMICAS PARA BUSCAR EL COMPONENTE BÁSICO QUE NECESITA
Haluros (hetero)arílicos y triflatos sustituidos:
2-cloro-5-(trifluorometil)pirazina
1-naftil trifluorometanosulfonato
Aminas alquílicas primarias o secundarias:
Otras aminas alquílicas primarias
aminas (hetero)arílicas:
Otras aminas aromáticas primarias
Carbamatos (como donante de amoníaco):
Ingredientes y aditivos básicos:
Solución de bis (trimetilsilil) amida de litio
Bis (trimetilsilil) amida de litio sólido
USE LA BARRA DE BÚSQUEDA SITUADA EN LA PARTE SUPERIOR DE LA PÁGINA PARA REALIZAR BÚSQUEDAS ESPECIFICAS POR NOMBRE DE PRODUCTO O NÚMERO CAS
Catalizadores / ligandos:
Precatalizadores de Pd:
Acetato de paladio, Pd(OAc)2 / [Pd(OAc)2]3
Bis (dibencilideneacetona) paladio (0), Pd (dba)2
Tris (dibencilideneacetona) dipalladio (0), Pd2(dba)3 (Alfa Aesar)
Tris (dibencilideneacetona) dipalladio (0), Pd2(dba)3 (Acros Organics)
Diclorobis (tri-o-tolilfosfina) paladio (II), PdCl2 (o-Tolyl3)
Dicloro [1,1'-bis (diciclohexilfosfino) ferroceno] paladio (II), PdCl2 (dppf)
Ligandos
1,1'-bis (difenilfosfino) ferroceno, DPPF
Xantfos, 9-dimetil-4,5-bis (difenilfosfino) xanteno
USE LA HERRAMIENTA DE BÚSQUEDA DE ESTRUCTURAS QUÍMICAS PARA BUSCAR EL COMPONENTE BÁSICO QUE NECESITA


