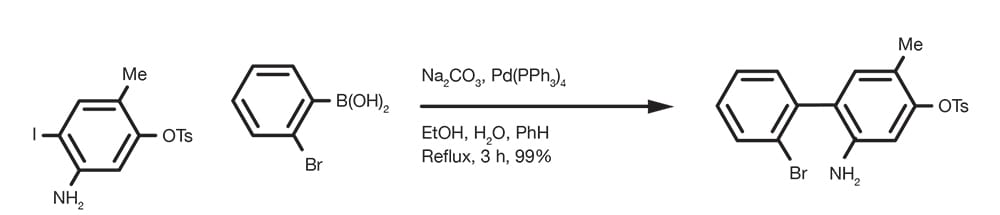
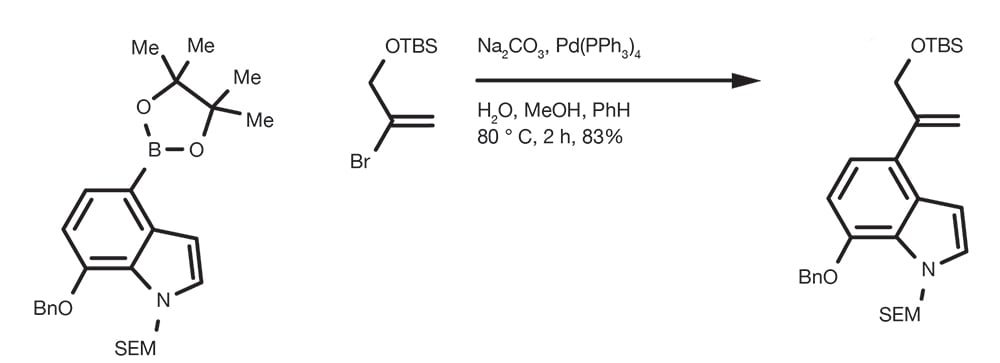
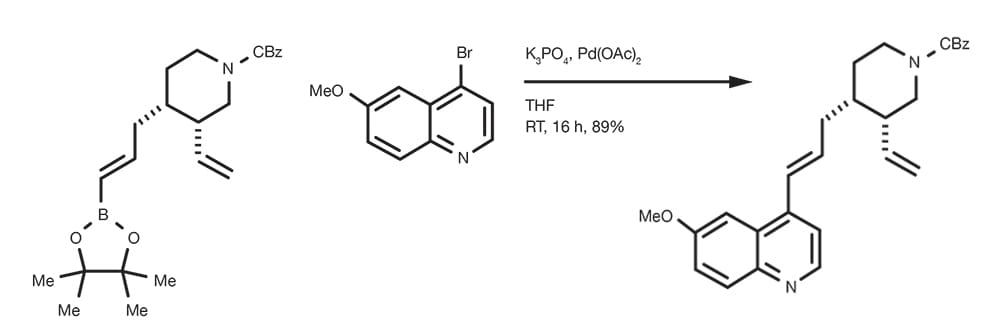
Reacción de acoplamiento de Suzuki-Miyaura
Las reacciones de acoplamiento carbono-carbono representan una de las revoluciones más importantes en la química orgánica y constituyen actualmente algunas de las reacciones más frecuentes en la química orgánica sintética. Su invención le valió a Akira Suzuki, Ei-Ichi Neghishi y Richard Heck el Premio Novel de Química en 2010.
Entre los diversos tipos de acoplamiento, el Suzuki-Miyaura, habitualmente denominado «acoplamientos de Suzuki», es probablemente el que ofrece más posibilidades y amplia aplicabilidad. La química de Suzuki se basa en el acoplamiento catalizado con Pd(0) de un haluro de arilo o vinilo con un ácido borónico de arilo o vinilo.
Sus ventajas con respecto a reacciones similares residen en las condiciones de reacciones leves, la disponibilidad habitual de los materiales de inicio y su toxicidad baja general. Los ácidos borónicos se preparan fácilmente, se encuentran ampliamente disponibles en el mercado y son considerablemente baratos. La reducción del impacto medioambiental y de los riesgos para la seguridad es otra de las ventajas que ofrece en comparación con el uso de compuestos de organocinc o de organostanano. Los productos derivados inorgánicos se eliminan fácilmente de la mezcla. A menudo, también es posible procesar las reacciones en agua, lo que ofrece beneficios evidentes a su perfil ecológico y, al mismo tiempo, abre el panorama para una amplia variedad de sustratos solubles en agua.
Desde su invención en 1979, se han logrado grandes avances y se ha notificado el uso extensivo de ácidos borónicos, ésteres y sales de trifluoroborato. Por otra parte, pueden considerarse los ácidos borónicos alquílicos a pesar de su reactividad más baja (con el uso de los catalizadores de última generación).
El alcance del otro reactivo de acoplamiento también se ha expandido a lo largo del tiempo y ahora incluye seudo haluros, como los triflatos o las sales de diazonio de arilo y los haluros alquílicos. La reactividad relativa del reactivo de acoplamiento haluro o seudohaluro es:
R-I > R-Br > R-OTf >> R-Cl
Arilo > Vinilo >> Alquilo
Los catalizadores de Pd homogéneos de última generación han reducido la carga de catalizador en términos de magnitud, lo que contribuye a la economía de la reacción que ahora se utiliza en diversos procesos comerciales. Es posible, y de hecho beneficioso, seleccionar diferentes catalizadores de complejos de Pd(0) relativamente simples, como el acetato de Pd y el tetraquispaladio o diversas formas de precatalizadores de Pd + ligandos de fosfina y (pre)catalizadores completamente formados, como complejos estables en aire para que el químico de laboratorio pueda manipularlos con mayor facilidad.
También se pueden usar catalizadores de Pd heterogéneos para algunos acoplamientos simples, aunque su reactividad es mucho más baja que la de los catalizadores homogéneos en sustratos altamente impedidos o electrófilos de baja reactividad (p. ej., Ar-Cl). El uso de sales de diazonio de arilo, a menudo denominadas «super electrófilos», como reactivos de acoplamiento hace que los catalizadores heterogéneos sean una opción bastante atractiva.
Protocolos de reacción de referencia
Pese haluro de arilo/vinilo (1 mmol) y el ácido/éster borónico (poco más de 1,1 mmol), catalizadores de paladio (0,5-10 % m/m), bromuro de tetrabutilamonio (1 mmol) y base (2,5 mmol). Disuelva en agua destilada o alcohol primario o secundario en un matraz con base redonda (con un equipo para agitación magnética y reflujo). Caliente sobre un baño de arena a la temperatura requerida (las reacciones de acoplamiento pueden llevarse a cabo a temperatura ambiente y hasta los 120-150 °C). Purgue el gas de nitrógeno mientras agita. Se recomienda realizar la reacción en un entorno de nitrógeno. Los tiempos de reacción generalmente varían entre 1 y 12 h.
La preparación de la reacción puede basarse en la filtración o extracción, dependiendo de la naturaleza química del producto.
Referencias bibliográficas clave
- Chem. Commun. 1979, 20 (36): 3437-3440.
https://doi.org/10.1016/S0040-4039(01)95429-2 - Chemical Reviews 1979, 95 (7): 2457–2483.
https://doi.org/10.1021%2Fcr00039a007 - J. Chem. Soc., Chem. Commun. 1979, 0 (1): 866-867.
http://dx.doi.org/10.1039/C39790000866 - Journal of Organometallic Chemistry 1999, 576 (1–2): 147-168.
https://doi.org/10.1016/S0022-328X(98)01055-9 - Pure and Applied Chemistry, 2009, 63 (3): 419–422.
https://doi.org/10.1351/pac199163030419 - ChemCatChem 2016, 8: 1998 – 2009
https://doi.org/10.1002/cctc.201600134
Product Selection
Catalizadores/ligandos:
USE LA HERRAMIENTA DE BÚSQUEDA DE ESTRUCTURAS QUÍMICAS PARA BUSCAR EL CATALIZADOR QUE NECESITA
Paladio(II) acetato, Pd(OAc)2 / [Pd(OAc)2]3
Paladio(0) tetrakis, Pd(PPh3)4
Trifluoroacetato de paladio (II), Pd(CF3COO)2
Acetilacetonato de paladio (II), Pd(acac)2
y
acetilacetonato de paladio (II), Pd(acac)2
Tris(dibencilidenacetona)dipaladio (0), Pd2(dba)3
dicloro [1,1'-bis (difenilfosfino) ferroceno] paladio (II)
Paladaciclos Xphos de 2.ª generación:
Dicloro[1,1”-bis(di-tert-butilfosfino)ferroceno]paladio(II), Pd(dbpf)Cl2
Dímero de cloruro de alilpaladio(II), [Pd(allyl)]2Cl2
Catalizadores alternativos:
Bis(trifenilfosfina)paladio(II) diacetato, Pd(PPh3)2(OAc)2
Bencil(cloro)bis(trifenilfosfina) paladio(II), Pd(PPh3)2BnCl
Diclorobis(tri-o-tolilfosfina)paladio(II), Pd(P(o-Tol)3)2Cl2
Diclorobis(triciclohexilfosfina) paladio(II), Pd(PCy3)2Cl2
Dicloro(1,5-ciclooctadieno)paladio(II), Pd(cod)Cl2
Bis[1,2-bis(difenilfosfino)etano] paladio(0), Pd(dppe)2
Dicloro[1,2-bis(difenilfosfino)etano] paladio(II), Pd(dppe)Cl2
Dicloro[bis(1,3-difenilfosfino)propano]paladio(II), Pd(dppp)Cl2
Dicloro[bis(1,4-difenilfosfino)butano]paladio(II), Pd(dppb)Cl2
Ingredientes y aditivos básicos:
Gel de sílice (para columna de purificación) 40-60 μm
Gel de sílice (para columna de purificación) 60-200 μm
USE LA BARRA DE BÚSQUEDA SITUADA EN LA PARTE SUPERIOR DE LA PÁGINA PARA REALIZAR BÚSQUEDAS ESPECIFICAS POR NOMBRE DE PRODUCTO O NÚMERO CAS
Componentes básicos:
USE LA HERRAMIENTA DE BÚSQUEDA DE ESTRUCTURAS QUÍMICAS PARA BUSCAR EL COMPONENTE BÁSICO QUE NECESITA
haluros (hetero)arílicos:
Etil 4-cloro-6-metoxiquinolina-3-carboxilato
OTf (hetero)arílico:
2-naftil trifluorometanosulfonato, 97 %
4-nitrofenil trifluorometanosulfonato, 99 %
OTf vinílico:
3,6-dihidro-2H-tiopirano-4-yl trifluorometanosulfonato
Ácidos borónicos (hetero)arílicos
Ácido 2-bromo-benceno-borónico, 98 %
Trifluoroboratos de vinilo:
Potasio 4-metil-beta-estiriltrifluoroborato, 95 %
Viniltrifluoroborato de potasio, 97 %
Sales de diazonio arílicas:
Tetrafluoroborato de 4- metoxibencenodiazonio, 97 %